戈沙妥珠单抗(Trodelvy)详细信息
所有名称:赛妥珠单抗,戈沙妥珠单抗,拓达维,Trodelvy,sacituzumab govitecan-hziy
Trodelvy(sacituzumab govitecan)用于治疗HR阴性和HER2阴性(有时称为三阴性)乳腺癌,在用至少两种其他癌症药物治疗后。
Trodelvy还用于治疗膀胱癌和尿路癌,在用铂金癌症药物和免疫疗法治疗后。
当癌症已经扩散到身体的其他部位(转移性)或无法通过手术切除时,使用Trodelvy。
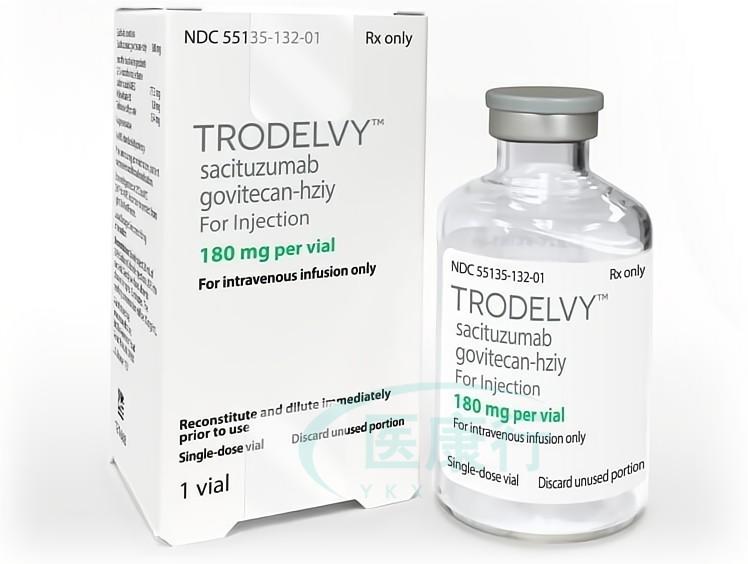
品牌:吉利德(Gilead Sciences,Inc)
结构:注射液
规格:180mg
价格:详询客服
注:本网站任何关于药品使用的建议仅供参考,不能替代医嘱
药品简介
Trodelvy(戈沙妥组单抗)是吉利德公司研发的一款抗Trop-2靶点的ADC药物,于2020年获得美国食品药品监督管理局(FDA)批准上市。Trodelvy(戈沙妥组单抗)是第一个可提高转移性三阴性乳腺癌(mTNBC)患者无进展生存期(PFS)和总生存期(OS)的疗法,标志着三阴性乳腺癌(mTNBC)治疗方面的一个重大进步。
2020年4月22日,美国食品药品监督管理局(FDA)已批准Trodelvy上市申请,用于先前至少接受过两次转移性疾病疗法治疗的,不可切除性局部晚期或转移性三阴性乳腺癌(mTNBC)成人患者。Trodelvy是FDA批准的首个专门治疗复发或难治性mTNBC的抗体药物偶联物(ADC)药物,也是FDA批准的首个抗人滋养层细胞表面抗原2(Trop-2)的ADC药物。
2021年4月7日,美国食品和药物管理局(FDA)批准Trodelvy(sacituzumab-govitecan-hziy)用于治疗之前接受过两次或更多的全身治疗,其中至少有一个是转移性疾病的,无法切除的局部晚期或转移性三阴性乳腺癌(TNBC)成年患者。
2021年4月13日,Trodelvy再获美国FDA批准一个新的适应症,用于治疗先前接受过含铂化疗、还接受过一种PD-1抑制剂或一种PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌(UC)成人患者。
Trodelvy也被开发用于治疗HR+/HER2-转移性乳腺癌和转移性非小细胞肺癌(NSCLC),对多种实体瘤的额外评估也在进行中。
2022年6月10日,国家药品监督管理局(NMPA)信息发布,戈沙妥珠单抗(商品名:拓达维,Trodelvy)在国内获批,这是全球首个且唯一获批的靶向Trop-2的ADC药物,用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者,三阴乳腺癌患者有了新的选择方案,打破现有治疗困境。
戈沙妥珠单抗(Trodelvy)详细说明书
赛妥珠单抗,戈沙妥珠单抗详细说明书
【生产企业】:Immunomedics公司
【规格】:180mg/剂
【商标】:Trodelvy
【中文名】:赛妥珠单抗
【英文名称】:sacituzumab govitecan-hziy injection
【性状】:无菌、无防腐剂的灰白色至淡黄色冻干粉末,静脉滴注用,装于50ml透明玻璃单剂量瓶中,配有橡胶塞、并用铝制翻盖进行卷曲密封。
【贮藏】:连同原剂量瓶保存在2°C到8°C(36°F到46°F)的冰箱中,注意闭光储存,请勿冷冻或摇晃。
【Trodelvy(sacituzumab govitecan-hziy)适应症和用途】:
用于先前已接受过至少两种疗法治疗的转移性三阴性乳腺癌(mTNBC)成人患者。
【Trodelvy(sacituzumab govitecan-hziy)剂量和给药方法】
1.本药是处方药,为静脉输液品;需由专业的医护人员配制给药。
2.在21天的治疗周期的第1天和第8天,每周给予本药1次。
3.第一剂的剂量滴注时间超过3小时,若患者能很好的耐受第一剂,则以后的滴注时间可控制在1至2小时。
4.每次给药前,需使用药物治疗以预防输液反应,如恶心和呕吐等。
5.在每次输液期间和之后的至少30分钟内,需对患者进行不良反应监测。
6.若患者出现输液有关的反应,医护人员需减慢滴注速度或暂时停止输液;如果出现危及生命的输液反应,则可能会永久停止使用本药治疗。
7.治疗时长由医护人员决定。
【Trodelvy(sacituzumab govitecan-hziy)给药配制】
1. 计算根据患者体重获得适当剂量所需本药配制溶液的所需体积。使用注射器从小瓶中取出此量。 丢弃小瓶中剩余的所有未使用部分。
2. 将所需体积的Trodelvy(sacituzumab govitecan-hziy)溶液慢慢注入聚丙烯(PP)输液袋中,以最大程度地减少泡沫。 请勿摇动。
3. 根据需要,使用0.9%氯化钠注射液(USP)调整输液袋中的体积,以获得1.1 mg / mL至3.4 mg / mL的浓度(总体积不应超过500 mL)。 对于体重超过170kg的患者,将本药的总剂量平均分配在两个500 mL输液袋之间,并通过缓慢滴注顺序进行给药。
4. 只能使用0.9%的氯化钠注射液(USP),因为尚未用其他基于输液的溶液确定重构产品的稳定性。请立即使用稀释的溶液。如果不立即使用,装有Trodelvy(sacituzumab govitecan-hziy)溶液的输液袋可在2°C至8°C(36°F至46°F)的冷藏条件下最多保存4小时。冷藏后,在4小时内(包括输注时间)使用稀释液。
【Trodelvy(sacituzumab govitecan-hziy)禁忌症】
对本药任何成分过敏患者禁用
【Trodelvy(sacituzumab govitecan-hziy)不良反应】
常见的不良反应有:疲倦;红细胞计数减少;脱发;便秘;皮疹;食欲减少;胃区(腹部)疼痛等。
本药可造成严重的不良反应,如:
1.中性粒细胞减少,症状可能有:发烧、寒冷、咳嗽、呼吸急促、小便时灼痛或疼痛
2.严重腹泻
3.严重和危及生命的过敏反应:脸、嘴唇、舌头或喉咙的肿胀;荨麻疹;皮肤出现皮疹或潮红;呼吸困难或气喘;头晕、感觉虚弱或昏厥;发冷或颤抖发冷;发烧等。
4.恶心、呕吐
说明书其他节更加详细讨论以上不良反应。
【Trodelvy(sacituzumab govitecan-hziy)警告和注意事项】
1.中性粒细胞减少:该不良反应很常见,严重时可导致感染甚至危及生命。治疗期间医护人员应监查患者血细胞计数;并根据情况适时调整患者本药用量或加用抗生素。忠告患者在治疗期间若出现以下任何感染迹象,需立即联系医护人员:发烧、寒冷、咳嗽、呼吸急促、小便时灼痛或疼痛。
2.严重腹泻:该不良反应很常见。医护人员需监测患者腹泻情况,并及时采取措施控制腹泻,如补充体液和电解质、降低本药剂量甚至停止使用本药等。忠告患者在治疗期间出现以下有关腹泻情况,需立即联系医护人员:在治疗期间出现第一次腹泻;出现黑色或带血的大便;流失过多体液及盐分(脱水)的症状,如头晕或昏厥;由于恶心或呕吐而无法通过口摄取液体;24小时内无法控制腹泻的情况等。
3.严重和危及生命的过敏反应:若在治疗期间出现任何过敏反应症状(见【Trodelvy(sacituzumab govitecan-hziy)不良反应】),忠告患者立即告诉医护人员。
4.恶心、呕吐:该不良反应较常见,有时甚至是严重的。因此在每次静脉滴注前需给予药物预防恶心呕吐。若出现无法控制的恶心呕吐现象,需降低本药量或终止治疗。
5.本药可能会导致女性生育问题,影响生育能力。
6.忠告患者主动告知医护人员自身医疗诊断情况,包括:
7.携带尿苷二磷酸葡萄糖醛酸基转移酶A1 (UGT1A1)*28的
戈沙妥珠单抗(Trodelvy)常见副作用
Enhertu最常见的副作用,当用于乳腺癌患者时,包括:
恶心
白细胞计数低
红细胞计数低
感觉疲倦
呕吐
脱发
肝功能检查增加
血小板计数低
便秘
食欲下降
腹泻
血钾水平低
咳嗽
Enhertu最常见的副作用,当用于胃癌患者时,包括:
红细胞计数低
白细胞计数低
血小板计数低
恶心
食欲下降
肝功能检查增加
感觉疲倦
腹泻
血钾水平低
呕吐
便秘
发烧
脱发
Enhertu可能导致男性的生育问题,这可能会影响生孩子的能力。