厄达替尼在尿路上皮癌中的临床研究数据如何?
艾达非替尼用途
尿路上皮癌
治疗局部晚期或转移性尿路上皮癌,伴有敏感的 FGFR-2 或 FGFR-3 基因组畸变(例如基因突变、基因融合),这些异常在既往接受过 ≥1 次含铂类药物治疗期间或之后进展,包括在含铂类药物治疗后 12 个月内进行新辅助或辅助治疗。
在复发或难治性局部晚期或转移性尿路上皮癌成人队列中,基于32.2%的客观缓解率加速批准; 对于此类患者,二线单药化疗(例如紫杉烷类药物、免疫检查点抑制剂 [例如帕博利珠单抗])的病史客观缓解约为 10-20%。 继续批准可能取决于验证性研究中临床益处的验证和描述。
在开始治疗之前,需要 FDA 批准的伴随诊断试验(例如,Qiagen 治疗筛查 FGFR RGQ RT-PCR 试剂盒),以确认是否存在 FGFR 基因组畸变。那么厄达替尼在尿路上皮癌中的临床研究数据如何?

研究BLC2001(NCT02365597)是一项多中心,开放标签,单臂研究,旨在评估BALVERSA在局部晚期或转移性尿路上皮癌(mUC)患者中的有效性和安全性。用于筛查和入组患者的成纤维细胞生长因子受体 (FGFR) 突变状态通过临床试验测定 (CTA) 确定。疗效人群包括一组 1 名患者,他们入组本研究的疾病在至少一次先前化疗时或之后进展,并且至少有以下遗传改变之一:FGFR3 基因突变(R248C、S249C、G370C、Y373C)或 FGFR 基因融合(FGFR3-TACC3、FGFR3-BAIAP2L1、FGFR2-BICC1、FGFR2-CASP7),由在中心实验室进行的 CTA 确定。来自69名患者的肿瘤样本由QIAGEN therascreen® FGFR RGQ RT-PCR试剂盒进行回顾性测试,该试剂盒是FDA批准的用于选择BALVERSA的mUC患者的测试。
在第8天和第9天之间血清磷酸盐水平低于5.5mg / dL目标的患者中,患者接受14mg的BALVERSA起始剂量,每日一次,剂量增加至17mg每日一次;41%的患者剂量增加。BALVERSA施用至疾病进展或不可接受的毒性。主要疗效结局指标是客观缓解率(ORR)和缓解持续时间(DoR),由盲法独立审查委员会(BIRC)根据RECIST v1.1确定。
中位年龄为67岁(范围:36至87岁),79%为男性,74%为白种人。大多数患者(92%)的基线东部肿瘤合作组(ECOG)体能状态为0或1。97%的患者有内脏转移。29例(10%)患者以前至少接受过一种顺铂或卡铂治疗。3%的患者仅接受既往基于顺铂的方案,1%的患者仅接受既往基于卡铂的方案,1%的患者同时接受顺铂和基于卡铂的方案。<>例(<>%)患者在既往仅接受含铂类新辅助治疗或辅助治疗后出现疾病进展。<>%的患者既往接受过抗PD-L<>/PD-<>治疗。
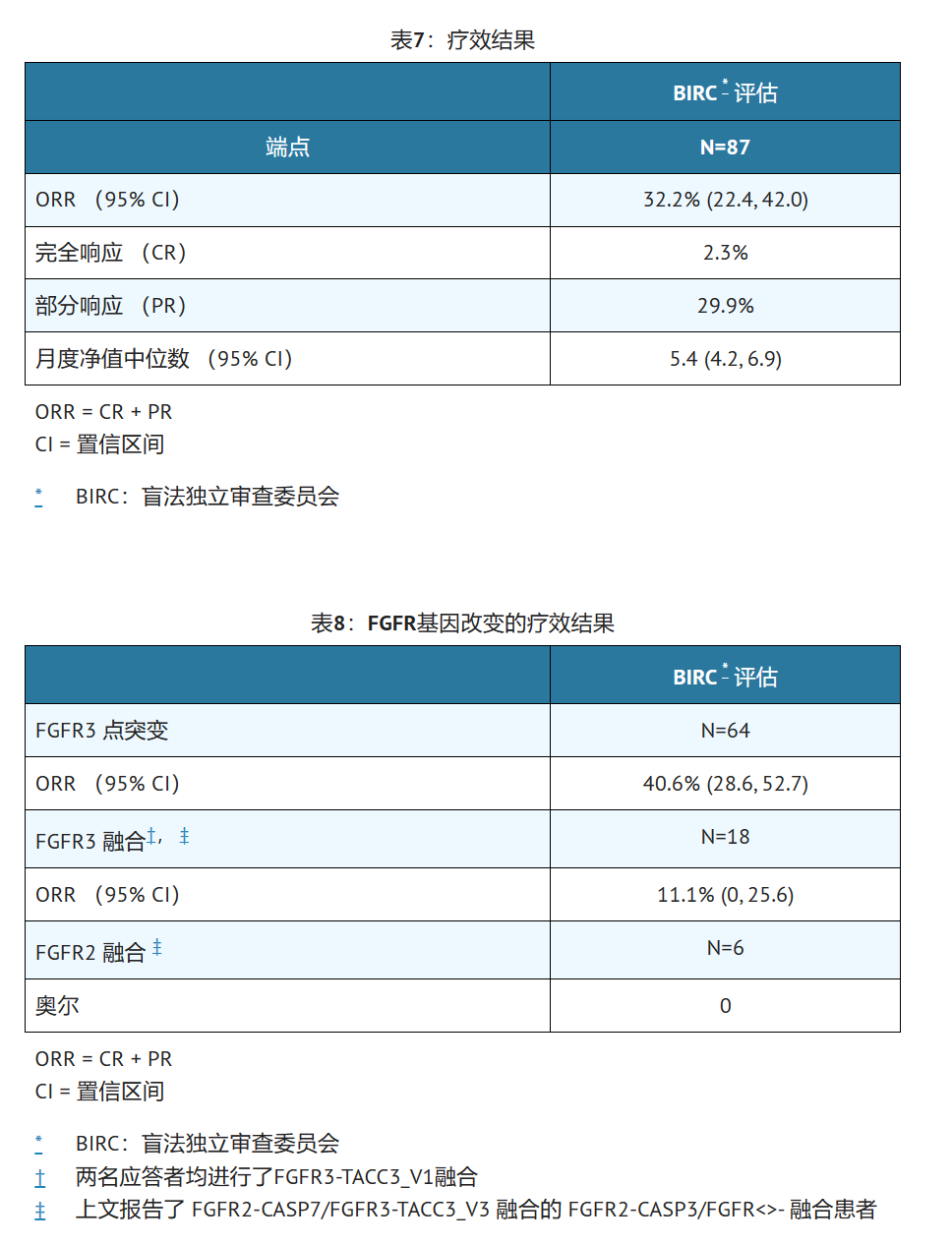
疗效结果总结于表7和表8。总缓解率为32.2%。应答者包括以前对抗PD-L1/PD-1治疗无反应的患者。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
