FGFR抑制剂的临床效果如何?
成纤维细胞生长因子受体(FGFR)基因家族的遗传改变,包括激活融合或重排、扩增和突变,与多种恶性肿瘤的发生有关。FGFR改变的致癌潜力促使开发了几种用于治疗肿瘤的小分子FGFR抑制剂,包括尿路上皮癌(UC)和胆管癌(CCA)。
埃达非替尼被批准用于治疗局部晚期或转移性UC,伴有FGFR2或FGFR3改变,这些改变在基于铂的化疗中取得了进展。Pemiginib和futilatinib被批准用于先前治疗的、不可切除的、局部晚期或移行性CCA,伴有FGFR 2融合或其他重排(futilatinb仅被批准用于肝内CCA)。5,6 2022年8月,在FIGHT-203研究中,基于有前景和持久的临床活性,pemigratinib被额外批准用于治疗FGFR1重排的复发或难治性骨髓/淋巴肿瘤(MLN)。
美国食品药品监督管理局(FDA)批准Infigratinib用FGFR2融合或其他重排治疗CCA;9然而,恩福替尼于2020年3月停止了分销。其他FGFR抑制剂,包括derazatinib、rogaratinib和RLY-4008,正在对多种癌症进行研究。
FGFR抑制剂的临床效果如何?
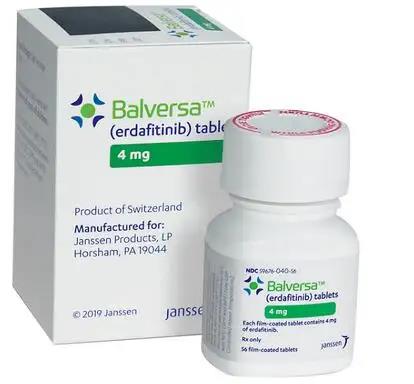
埃达非替尼是一种FGFR1–FGFR4的抑制剂,已被批准用于治疗在先前铂类化疗期间或之后发生的具有易感FGFR2或FGFR3基因改变的局部晚期或转移性UC,客观缓解率(ORR)为40%(包括4个完全缓解[CRs]),中位无进展生存期(PFS)为5.5个月,中位总生存期(OS)为11.3个月。
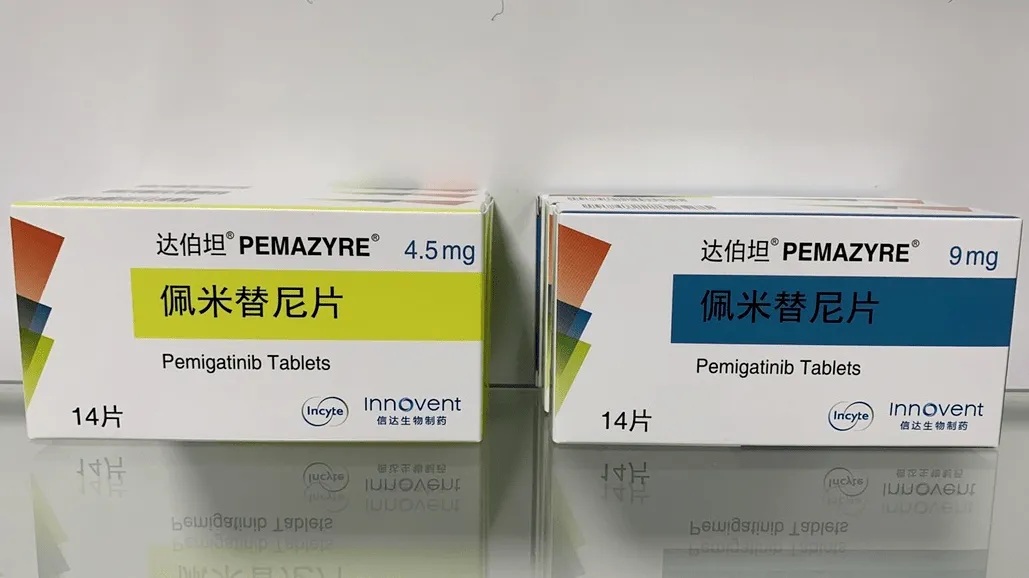
Pemiginib是FGFR1、FGFR2和FGFR327的强效抑制剂,已被批准用于先前治疗的、不可切除的、局部晚期或转移性CCA(FGFR2融合或其他重排)和复发或难治性MLN(FGFR1重排)。在FIGHT-202研究的初步分析中(N=146),15,24 CCA和FGFR2融合或重排患者的ORR为35.5%(包括3个CR),中位PFS为6.9个月,中位OS为21.1个月。15在FIGHT-203(N=34)中最近一项关于培咪唑尼治疗FGFR1重排MLN的分析中,每位研究者的CR率为64.5%,每位研究人员的完全细胞反应率为72.7%。
FGFR1–FGFR4抑制剂infigratinib30被批准用于既往接受过FGFR2融合或其他重排治疗的、不可切除的、局部晚期或转移性CCA的成年人,但已退出CCA的分销。在infigratini对FGFR2融合或其他重排患者的关键II期试验中(N=108),ORR为23.1%(包括1 CR),PFS中位数为7.3个月,OS中位数为12.2个月。
不可逆的FGFR1–FGFR4抑制剂富替巴替尼也被批准用于既往接受过治疗、不可切除、局部晚期或转移性iCCA伴FGFR2基因融合或其他重排的成人。在FOENIX-CCA2 II期研究中,对既往接受过FGFR抑制剂治疗、未接受治疗、局部晚期和转移性不可切除的iCCA和FGFR2融合或重排的患者(N=103),ORR为41.7%,中位PFS为9.0个月,中位OS为21.7个月。其他FGFR抑制剂,如derazatinib、 rogaratinib、和RLY-4008,正在临床开发中。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
